Blog
IMPACTO DEL COVID 19 EN ACALASIA TIPO II
- septiembre 5, 2022
- Publicado por: Maria Nazz Vega
- Categoría: Trabajos de investigación
Dr. Raul Aponte.
Clinica Gastro Bariatrica. Maracay. Estado Aragua. Venezuela.
Dra. Nefertiti Daulabani.
Clinica Gastro Bariatrica. Maracay. Estado Aragua. Venezuela.
Dra. Rosargelis Parra.
Clinica Gastro Bariatrica. Maracay. Estado Aragua. Venezuela.
Dr José Roberto Soto
Clinica Gastro Bariatrica. Maracay. Estado Aragua. Venezuela.
Luis Perez-Ybarra.
Universidad de Carabobo. Facultad de Ciencias de la Salud. Escuela de Bioanalisis Sede
Aragua. Departamento de Ciencias Basicas. Maracay. Estado Aragua. Venezuela.
Autor de correspondencia: Dr. Raul Aponte. Clinica Gastro Bariatrica. Maracay, estado Aragua,
Venezuela. Celular: +58-414-4543644. E-mail: raulaponterendon@hotmail.com
Financiamiento: Propio.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Aval del comite de etica: El protocolo de investigacion fue aprobado por el Comite de Etica de la
Institucion.
Summary
Introduction: Achalasia is a rare esophageal motor disorder with a worldwide prevalence of
around 10 cases per 100 000 inhabitants, and an incidence of one new case per 100 000 inhabitants
per year. It is characterized by loss or decrease of myenteric plexus neurons in the distal esophagus
and lower esophageal sphincter, presenting with dysphagia and regurgitation.
Objective: To show evidence that the presence of type II achalasia could be a sequela of the
COVID-19 infection.
Materials and methods: Patient histories were reviewed during the 2015 to june-2022 period, the
frequencies of achalasia with and without COVID-19 were calculated for the period considered.
Patient profiles were constructed by using cluster analysis based on clinical variables.
Results: It was found that the frequency of patients with achalasia during the years 2020 to June-
2022 was higher than that observed in previous years, during this period 57% of patients with
achalasia had presented COVID-19 infection, statistically association was found between the type
of achalasia and COVID19 infection (p<0.001), all patients with previous COVID19 infection had
type II achalasia, finally, patients with type I and III achalasia had different profiles than patients
with type II achalasia according to cluster analysis.
Conclusion: These results seem to indicate type II achalasia could be a sequela of COVID-19
infection. The possible etiopathogenic implications of these results are discussed, as well as their
clinical relevance.
Keywords: Achalasia, COVID-19, SARS-CoV-2.
RESUMEN
Introducción: La acalasia es un trastorno motor esofágico poco común con prevalencia mundial
de alrededor de 10 casos por 100 000 habitantes, e incidencia de un nuevo caso por 100 000
habitantes anual. Se caracteriza por pérdida o disminución de las neuronas del plexo mientérico en
el esófago distal y esfínter esofágico inferior cursando con disfagia y regurgitación.
Objetivo: Mostrar evidencias de que la presencia de acalasia tipo II pudiera ser una secuela de la
infección por COVID-19.
Materiales y métodos: Se revisaron las historias clínicas de pacientes durante el periodo 2015 a
junio-2022, se calcularon las frecuencias de acalasia con y sin COVID-19 para el período
considerado. Se construyeron los perfiles de los pacientes a través del análisis por conglomerados
en función de las variables clínicas.
Resultados: Se encontró que la frecuencia de pacientes con acalasia durante los años 2020 a junio-
2022 fue mayor que la observada en años previos, durante este período 57% de los pacientes con
acalasia habían presentado infección por COVID-19, se encontró asociacion estadísticamente
significativa entre el tipo de acalasia y la infección por COVID19 (p<0,001), todos los pacientes
con infección previa de COVID19 presentaron acalasia tipo II, finalmente, los pacientes con
acalasia tipo I y III presentaron perfiles diferentes a los pacientes con acalasia tipo II según el
análisis por conglomerados.
Conclusión: Estos resultados parecen indicar que la acalasia tipo II pudiera ser una secuela de la
infección por COVID-19. Se discuten las posibles implicaciones etiopatogénicas de estos
resultados, así como su relevancia clínica.
Palabras clave: Acalasia, COVID-19, SARS-CoV-2.
INTRODUCCION
La acalasia es un trastorno motor del esófago causado por pérdida o disminución de las neuronas del plexo mientérico en el esófago distal y esfínter esofágico inferior (EEI) produciendo aperistalsis y ausencia de relajación del esfínter. Los síntomas incluyen disfagia, regurgitación de alimentos, dolor toráxico y pérdida de peso. (1) La prevalencia mundial es de 10 casos por 100 000 habitantes, con incidencia anual de 1 nuevo caso por 100 000 habitantes. (1)
La motilidad esofágica es compleja implicando inervación extrínseca y arcos reflejos locales, donde además de neurotrasmisores excitadores clásicos como la acetilcolina e inhibidores como el péptido vaso intestinal y el óxido nítrico existen varios cotransmisores como el sistema Renina–Angiotensina (SRA) en la musculatura del esófago distal y la Angiotensina II (AII) como potente estimulador de las contracciones esofágicas a través del receptor ATR1 (receptor de la angiotensina 1), sugiriendo que la AII participa en el control de la actividad motora esofágica. (2) La enzima convertidora de Angiotensina (ECA) se encuentra en las paredes capilares ubicado en el ápice de las papilas y en las paredes de los vasos sanguíneos de la lámina propia del esófago distal. (3)
El virus SARS-CoV-2 es un virus monocatenario (β coronavirus). Ingresa a las células huésped a través del receptor de la enzima convertidora de angiotensina-2 (ACE2). Una vez dentro, experimenta replicación y maduración, provocando respuesta inflamatoria con activación e infiltración de células inmunitarias por varias citoquinas. (3) El receptor ACE2 está presente en numerosos tipos de células en todo el cuerpo humano, incluyendo cavidad oral, nasal, pulmones, corazón, células epiteliales esofágicas, glandulares gástricas, enterocitos, hígado, riñones, bazo, cerebro, sangre arterial, venosa y células endoteliales. De esta manera el SARS-CoV-2 puede causar daño a múltiples órganos (4) y su expresión varía mucho en relación con el espectro de síntomas, que van desde asintomáticos, espectro moderado o síntomas severos que conducen a la muerte. (3) Si bien la infección por COVID-19 afecta principalmente el sistema respiratorio, también puede manifestarse con síntomas gastrointestinales que aparecen con mayor frecuencia en la fase aguda como hiporexia, ageusia, náuseas, vómitos, dolor abdominal, diarrea y sangrado gastrointestinal inferior (3). Aunque la edad, el sexo y las comorbilidades se han descrito como los principales determinantes de gravedad del COVID19, existe sustancial variabilidad en su presentación que pudiera deberse a variantes genéticas específicas en pacientes afectados. Estudios histopatológicos de biopsias recogidas por endoscopia mostraron daño a la mucosa del tubo digestivo, con numerosas células plasmáticas y linfocitos infiltrados en la lámina propia del esófago, estómago, duodeno y recto. (5)
En esta comunicación se pretende mostrar evidencia de que el aumento de la frecuencia de pacientes con acalasia secundaria diagnosticados en la Unidad de Motilidad Esofágica de la Clínica Gastro Bariátrica ubicada en Maracay, Estado Aragua, Venezuela, durante los años 2020 y junio-2022 pudiera tener relación con infección previa a COVID19. Esta coexistencia parece superior a lo esperado y consideramos importante su divulgación habida cuenta de que se desconocen muchos aspectos sobre los alcances de la infección por COVID 19.
MATERIALES Y MÉTODOS
Sujetos y criterios de inclusión
Estudio retrospectivo. Se incluyeron pacientes que asistieron a la Unidad de Motilidad Esofágica de la Clínica Gastro Bariátrica en Maracay, estado Aragua, Venezuela, para diagnóstico manométrico por sospecha de acalasia por presentar disfagia y pérdida de peso como síntomas dominantes entre enero 2015 y junio 2022.
Se utilizó la clasificación de Chicago v3.3 (6) para el diagnóstico manométrico y definición de los fenotipos de acalasia. La manometría se realizó con equipo de perfusión de agua Medical Measurement Systems® (Enschede, NL) de 22 sensores, progresando el transductor por vía transnasal hasta estómago con el paciente en ayunas y en posición semisentada (45°). El protocolo de manometría incluyó 5 tragos de 20 mL de agua y test de tragos múltiples con 200 mL de agua para determinar la reserva funcional del esófago. Este estudio fue aprobado por el Comité de Ética Médica de la institución.
Se revisaron las historias clínicas, hallazgos endoscópicos, manométricos correspondientes al período de estudio y se contaron cuántos pacientes presentaron acalasia. La severidad de los síntomas se midió con la puntuación de Eckardt. El tiempo de la enfermedad se estimó desde la aparición de los primeros síntomas hasta el diagnóstico de acalasia por manometría. Los signos endoscópicos utilizados fueron dilatación de esófago y retención de líquidos o alimentos. Para los años 2020 al 2022 se contaron cuántos pacientes con acalasia habían presentado infección previa por COVID19, ya fueran sospechosos por la presencia de síntomas o confirmados por prueba de reacción en cadena polimerasa (PCR).
Análisis estadístico
Se calcularon los intervalos de confianza exactos al 95% para la proporción de pacientes con acalasia, con y sin infección previa por COVID19.
La homogeneidad de la frecuencia de infección anual y la asociación entre la presencia de acalasia y la infección previa por COVID19 se analizó con la prueba de chi-cuadrado (χ2).
Los perfiles de los pacientes para los años 2020 al 2022 se obtuvieron mediante el análisis de conglomerados utilizando la distancia euclídea cuadrática a partir de las variables estandarizadas y el método de agrupamiento de Ward considerando las variables edad (años), reserva peristáltica, grado de acalasia, tiempo transcurrido desde los primeros signos y síntomas (meses), score de Eckardt y resultados de la endoscopia. Se construyó el dendrograma y se caracterizaron los individuos pertenecientes a cada clúster identificable por simple inspección. Los datos se procesaron con los programas R 4.1.1 y SPSS 26.0.
RESULTADOS
Los registros previos a la pandemia de COVID19 en la consulta de gastroenterología de la Clínica Gastro Bariátrica mostraron una frecuencia bastante baja para la presencia de acalasia, oscilando entre 0,18% (1/561) para el año 2016 y 2,15% (15/698) para el año 2015, además, no fue homogénea durante el período prepandemia (χ2=12,42; p=0,014), durante la pandemia, en cambio, las frecuencias de pacientes diagnosticados con acalasia han oscilado entre 2,87% (13/453) para el año 2020 y 3,69% (28/758) para el año 2021, los cuales son mayores que los diagnosticados antes de la pandemia, además, las frecuencias fueron homogéneas durante el período de pandemia considerado (χ2=0,59; p=0,745), ver figura 1. Por otra parte, de los 61 pacientes diagnosticados con acalasia durante la pandemia, 15 (15/61; 24,59%; IC95%=14,46%-37,29%) presentaron acalasia tipo I, 44 (44/61; 72,13%; IC95%=59,17%-82,29%) acalasia tipo II y el resto (2/61; 3,28%; IC95%=0,40%-11,35%) acalasia tipo III.

Figura 1. Distribución de frecuencias relativas de los casos de acalasia atendidos en la Clínica Gastro Bariátrica. Maracay-Venezuela. 2015 a junio-2022.
Si bien los casos de acalasia vienen en aumento desde el año 2019, posiblemente debido a que se trata de un centro especializado en motilidad esofágica de referencia a nivel nacional, lo que realmente nos hace sospechar que existe una relación entre la acalasia y la COVID19 se puede apreciar para los resultados de los años 2020 al 2022.
Para el año 2020, de los 13 pacientes diagnosticados con acalasia, solamente 3 pacientes (3/13; 23,08%; IC95%=5,04%-53,81%) presentaron clínica concordante con COVID19, lamentablemente, estos tres casos no fueron confirmados por PCR, sin embargo, para el año 2021, durante el cual los casos de COVID19 aumentaron notablemente en el país así como el uso de la pruebas de diagnóstico por PCR, se tuvo que de los 28 casos atendidos por acalasia, 9 (9/28; 32,14%; IC95%=15,88%-52,35%) no presentaron COVID19, mientras que del resto de los pacientes, 8 presentaron infección clínica de COVID19 sin confirmación por PCR (8/28; 28,57%; IC95%=13,22%-48,67%) y 11 infección por COVID19 confirmada por PCR (11/28; 39,29%; IC95%=21,50%-59,42%), es decir, 19 pacientes (19/28; 67,86%, IC95%=47,65%-84,12%) mostraron evidencias de infección por COVID19, asimismo, entre enero y junio del año 2022 se tuvo que de los 20 casos atendidos por acalasia, 7 (7/20; 35%; IC95%=15,39%-59,22%) no presentaron COVID19, mientras que del resto de los pacientes, 3 presentaron infección clínica de COVID19 sin confirmación por PCR (3/20; 15%; IC95%=3,21%-37,89%) y 10 infección por COVID19 confirmada por PCR (10/20; 50%; IC95%=27,20%-72,80%), es decir, 13 pacientes (13/20; 65%; IC95%=40,78%-84,61%) mostraron evidencias de infección por COVID19, además, todos los pacientes con clínica o infección por COVID19 confirmada por PCR durante el período considerado presentaron acalasia tipo II (35/35; 100%; IC95%=91,80%-100%). Así, 57,38% (35/61; IC95%=44,05%-69,96%) de los pacientes diagnosticados con acalasia habían presentado infección previa por COVID19. En ese sentido, la prueba de independencia de χ2 indicó que hay asociación estadísticamente significativa entre el diagnóstico de acalasia y la infección previa por COVID19 (χ2=31,73; p<0,001), de tal manera que 79,5% (35/44) de los pacientes diagnosticados con acalasia tipo II habían presentado previamente infección por COVID19 y ningún paciente diagnosticado con acalasia tipo I o III había presentado infección previa por COVID19, ver tabla 1 y figura 2.
Tabla 1. Distribución de frecuencias absolutas y relativas (%) para los tipos de acalasia clasificados por infección previa de COVID19.
| Variable | Categorías | Infección previa por COVID19 (%) | χ2 | p-valor | ||
| Sin COVID19 | PCR+ | Síntomas+ | ||||
| Acalasia | Tipo I | 15 (100) | 0 (0) | 0 (0) | 31,73 | <0,001* |
| Tipo II | 9 (20,5) | 21 (47,7) | 14 (31,8) | |||
| Tipo III | 2 (100) | 0 (0) | 0 (0) | |||
Nota: (*) Asociación estadísticamente significativa al 5%. Porcentajes calculados por filas.
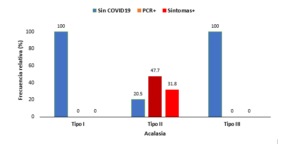
Figura 2. Distribución de frecuencias relativas (%) para los tipos de acalasia clasificados por infección previa de COVID19. Porcentajes calculados dentro de los tipos de acalasia.
Por otra parte, en el dendrograma del análisis por conglomerados pueden distinguirse dos clústeres (figura 3), en éstos se observa que el clúster 1 solo incluyó a pacientes que no presentaron infección previa por COVID19 (20/20; 100%), mientras que en clúster 2 predominaron pacientes que presentaron infección previa por COVID19 (32/37; 86,49%). Cuatro pacientes fueron excluidos del análisis por conglomerados por no contar con registros completos para todas las variables.

Figura 3. Dendrograma para pacientes con acalasia. Años 2020 al 2022. Clúster 1: color azul. Clúster 2: color vino tinto. No: pacientes sin COVID19. Síntomas: pacientes con signos clínicos de COVID19. PCR: pacientes con infección por COVID19 confirmada por PCR.
Los perfiles de los pacientes agrupados por clúster se muestran en la tabla 2, en esta puede apreciarse que los pacientes del clúster 1 tendieron a presentar ligeramente mayor edad que los del clúster 2, pero un tiempo promedio mucho mayor de aparición de síntomas y un promedio mayor para el score de Eckardt, además, ningún paciente incluido en el clúster 1 presentó reserva peristáltica en contraposición al 86,5% de los pacientes del clúster 2 que sí la presentaron, asimismo, solamente 15% de los pacientes del clúster 1 presentaron acalasia tipo II mientras que todos los pacientes del clúster 2 la presentaron, por otra parte, solamente 10% de los pacientes del clúster 1 presentaron endoscopia normal mientras que 75,7% de los pacientes del clúster 2 presentaron endoscopias sin alteraciones, finalmente, ningún paciente del clúster 1 presentó infección previa por acalasia mientras que 86,5% de los pacientes del clúster 2 presentaron infección previa por acalasia, distribuidos en 35,1% por síntomas y clínica y 51,4% confirmados por PCR.
Tabla 2. Perfiles de las variables para los pacientes agrupados por clúster.
| Variable | Clúster 1 | Clúster 2 | |
| Edad () | 54,85 | 44,35 | |
| Tiempo síntomas () | 31,65 | 8,81 | |
| Score de Eckardt () | 9,40 | 6,86 | |
| Reserva peristáltica n (%) | Presente | 0 (0) | 32 (86,5) |
| Ausente | 20 (100) | 5 (13,5) | |
| Acalasia n (%) | I | 15 (75) | 0 (0) |
| II | 3 (15) | 37 (100) | |
| III | 2 (10) | 0 (0) | |
| Endoscopia n (%) | Normal | 2 (10) | 28 (75,7) |
| Dilatación | 9 (45) | 5 (13,5) | |
| Retención | 3 (15) | 4 (10,8) | |
| Dilatación y Retención | 6 (30) | 0 (0) | |
| Covid19 n (%) | No | 20 (100) | 5 (13,5) |
| Síntomas y clínica | 0 (0) | 13 (35,1) | |
| Confirmado por PCR | 0 (0) | 19 (51,4) |
Nota: Los porcentajes por clúster para cada variable se presentan entre paréntesis
los pacientes que presentaron COVID19 tendieron a presentar acalasia más reciente y con menor grado de avance de la alteración esofágica. Estos resultados nos hacen sospechar que los pacientes que previamente padecieron COVID19 pudieran haber presentado acalasia tipo II como una secuela de la infección.
DISCUSIÓN
La acalasia es un trastorno motor esofágico caracterizado por pérdida o disminución de las neuronas del plexo mientérico en el esófago distal y EEI. De etiología desconocida, existe predisposición genética individual y respuesta autoinmune a un agente desencadenante desconocido, como virus (herpes simple, herpes zoster, sarampión). (5) Los pacientes con acalasia tienen más probabilidades de tener enfermedades autoinmunes concomitantes que la población general y la prevalencia de autoanticuerpos neurales séricos es más alta, sugiriendo etiología autoinmune. Gaber et al. (7) reportaron entre 6 769 casos de acalasia y 27 076 controles, mayores probabilidades de acalasia con condiciones autoinmunes (OR=1,26, IC95%=1,11-1,42). La presencia de cualquiera de las infecciones virales estudiadas también se asoció con un mayor riesgo de acalasia (OR=1,58, IC95%=1,23-2,01). El virus de la varicela zóster (OR=3,84, IC95%=1,94-7,62) y el virus del papiloma humano (OR=1,77, IC95%=1,15-2,73) tenían una estrecha relación con la acalasia. La reacción inflamatoria se asocia a un infiltrado de linfocitos de células T que conduce a destrucción lenta de las células ganglionares. La distribución y el resultado final de ésta plexitis es variable y puede ser modificado por la respuesta del huésped o el estímulo etiológico. La manometría de esófago de alta resolución constituye la prueba ideal para el diagnóstico de acalasia y ha permitido establecer varios fenotipos. Tipo I: ausencia de contractilidad del músculo liso del cuerpo esofágico, representa la etapa tardía con pérdida del tono muscular y dilatación de esófago. Tipo II: con presurización pan esofágica, la musculatura lisa conserva su tono y propiedades biofísicas, y las degluciones generan aumentos de presión isobárica pan esofágica. Se considera que representa un estado temprano de la enfermedad. (5)
Los pacientes tipo I tienden a presentar dilatación esofágica más severa con peristalsis casi ausente, ausencia de reserva peristáltica, representan una progresión del tipo II con descompensación del cuerpo esofágico. Los pacientes tipo II corresponden a la etapa temprana de la enfermedad sin dilatación esofágica, con presurización a cada deglución y reserva peristáltica. Sodidkoff et al.(8) estudiando los patrones histopatológicos entre los subtipos de acalasia observaron mayor grado de pérdida de células ganglionares en acalasia tipo I en comparación con el tipo II, sugiriendo que la acalasia tipo I representa una progresión de la acalasia tipo II.
Aunque los mecanismos de las manifestaciones gastrointestinales provocados por el SARS-CoV-2 aún se desconocen, está claro el papel de los receptores ACE2 en el esófago, intestino delgado y colon. Éstos están altamente expresados en el tracto gastro intestinal (TGI) incluso más abundantemente que en los pulmones, por lo tanto, puede servir como un sitio de destino viral. (4)
Se ha demostrado que AII ejerce potentes efectos contráctiles a través de AT1R en el cuerpo esofágico y esfínter esofágico inferior. Casselbrant et al. (9) reportaron la presencia de un SRA local en la capa muscular esofágica en personas sanas y en pacientes con acalasia utilizando análisis de transferencia Western, inmunohistoquímica y PCR. Los resultados mostraron diferencias en las enzimas responsables de la producción de AII y cambio en la fisiología del receptor de AT1R al Mas-receptor en pacientes con acalasia, sugiriendo un rol importante en la fisiopatología de la acalasia.
Existe información muy limitada sobre la naturaleza y prevalencia de los síntomas post COVID19 después del evento agudo. Halpin et al. (10) con 100 pacientes sobrevivientes de COVID19 establecieron la prevalencia a las 8 semanas de 5% de pacientes con disfagia no explicada, aunque no se investigó la causa.
Dado que habían transcurrido más de 12 semanas desde la infección por COVID-19 y la presencia de disfagia y el diagnóstico de acalasia, esto nos hizo suponer que la alteración del trastorno motor de esófago aparece como manifestación tardía de la infección viral, conocida como COVID prolongado. Este término se usa para describir signos y síntomas que continúan o se desarrollan después de un brote agudo de COVID19. Incluye tanto COVID19 sintomático en curso (de 4 a 12 semanas) como síndrome post COVID19 (12 semanas o más). Por lo general, se presenta con grupos de síntomas, a menudo superpuestos, que pueden fluctuar y cambian con el tiempo y pueden afectar cualquier sistema del cuerpo. (11)
Este análisis proporciona una visión clínica, endoscópica y manométrica de un grupo de pacientes evaluados por disfagia como síntoma dominante con el antecedente común de haber sufrido infección por COVID19 al menos 5 meses antes del momento del estudio manométrico. La presentación clínica de la infección fue de curso leve, ninguno de los pacientes hubo de ser hospitalizado, siendo tratados ambulatoriamente en su domicilio.
Esta investigación tiene limitaciones. Primero, es un estudio retrospectivo y por ser nuestra Unidad un centro de referencia nacional de manometría de esófago, para la recolección de datos nos enfocamos en los informes disponibles enviados por los médicos tratantes; en consecuencia, en algunos casos, fue necesaria la interpretación de los datos, lo que podría haber causado un sesgo de información, minimizamos esto último con comunicación telefónica para obtener información adicional. En segundo lugar, la muestra constituye un número relativamente pequeño de pacientes con infección a COVID19, disfagia y diagnóstico manométrico de acalasia tipo II. Sin embargo, el número de casos de acalasia fue mayor al esperado, y los pacientes con y sin infección previa por COVID19 presentaron perfiles diferentes según el análisis por conglomerados. Los casos limitados influyeron en el tipo de análisis estadístico que se realizó. Finalmente, el objetivo del estudio no era desarrollar un modelo de predicción para la infección por COVID19 y acalasia, sino dar una idea de la causalidad y la necesidad de tomar en cuenta en casos de pacientes con antecedentes de COVID19 de curso benigno y desarrollo de disfagia en etapa post COVID19 que permita mejorar el manejo de estos pacientes
REFERENCIAS BIBLIOGRÁFICAS
- Vaezi MF, Pandolfino JE, Vela MF. ACG clinical guideline: diagnosis and management of achalasia. Am J Gastroenterol. 2013;108(8):1238-49; quiz 1250. PMID: 23877351. DOI: https://doi.org/10.1038/ajg.2013.196
- Mascolo A, Scavone C, Rafaniello C, Ferrajolo C, Racagni G, Berrino L, et al. Renin-Angiotensin system and coronavirus disease 2019: a narrative Review. Front Cardiovasc Med. 2020;7:143. PMID: 32850989. DOI: https://doi.org/10.3389/fcvm.2020.00143
- Cheung KS, Hung IFN, Chan PPY, Lung KC, Tso E, Liu R, et al. Gastrointestinal manifestations of SARS-CoV-2 infection and virus load in fecal samples from a Hong Kong cohort: systematic review and meta-analysis. 2020;159(1):81-95. PMID: 32251668. DOI: https://doi.org/10.1053/j.gastro.2020.03.065
- Casselbrant A, Edebo A, Hallersund P, Spak E, Helander HF, Jönson C, et al. Angiotensin II receptors are expressed and functional in human esophageal mucosa. Am J Physiol Gastrointest Liver Physiol. 2009.297(5):G1019–27. PMID: 19779016. DOI: https://doi.org/10.1152/ajpgi.00255.2009
- Pandolfino JE, Gawron AJ. Achalasia: a systematic review. JAMA. 2015.313(18):1841–52. PMID: 25965233. DOI: https://doi.org/10.1001/jama.2015.2996
- Kahrilas PJ, Bredenoord AJ, Fox M, Gyawali CP, Roman S, Smout AJPM, et al. The Chicago classification of esophageal motility disorders, v3.0. Neurogastroenterol Motil. 2015;27(2):160-74. PMID: 25469569. DOI: https://doi.org/10.1111/nmo.12477
- Gaber CE, Cotton CC, Eluri S, Lund JL, Farrel TM, Dellon ES. Autoimmune and viral risk factors are associated with achalasia: A case – control study. Neurogastroenterolol Motil. 2021;e14312. PMID: 34957646. DOI: https://doi.org/10.1111/nmo.14312
- Sodikoff JB, Lo AA, Shetuni BB, Kahrilas PJ, Yang, GY, Pandolfino JE. Histopathologic patterns among achalasia subtypes. Neurogastroenterol Motil. 2016;28(1):139–45. PMID: 26542087. DOI: https://doi.org/10.1111/nmo.12711
- Casselbrant A, Kostic S, Lönroth H. The muscular expression of RAS in patients with achalasia. J Renin Angiotensin Aldosterone Syst. 2015;16(3):578-86. PMID: 24468662. DOI: https://doi.org/10.1177/1470320313498294
- Halpin SJ, McIvor C, Whyatt G, Adams A, Harvey O, McLean L, et al. Postdischarge symptoms and rehabilitation needs in survivors of COVID-19 infection: A cross-sectional evaluation. J Med Virol. 2021;93(2):1013-22. PMID: 32729939. DOI: https://doi.org/10.1002/jmv.26368
- Crook H, Raza S, Nowell J, Young M, Edison P. Long covid-mechanisms, risk factors, and management. 2021;374:n1648. PMID: 34312178. DOI: https://doi.org/10.1136/bmj.n1648
